清华研究揭示SIRT6在癌症恶病质脂肪代谢中的关键作用
清华新闻网2月24日电 近日,清华大学药学院王钊课题组研究揭示了SIRT6蛋白通过抑制TNFR2信号通路缓解癌症恶病质脂肪消耗的关键机制,为恶病质的治疗与药物开发提供了新的视角与科学依据。
癌症恶病质是一种以能量代谢失衡、脂肪与肌肉进行性消耗为特征的多器官综合征,约30%的癌症患者直接死因与此相关,患者代谢失衡、器官衰竭,严重影响抗肿瘤治疗耐受性,但临床上尚无有效干预手段。脂肪组织异常分解被认为是恶病质早期的关键事件,但其分子调控机制长期未明。SIRT6作为著名的长寿基因,此前已被发现能调控代谢、抵抗肥胖,但其在癌症恶病质中的作用尚属空白。
研究团队从临床数据出发,发现胃癌患者中,非恶病质患者的血清SIRT6水平显著高于恶病质患者,由此提出假设:SIRT6或通过调控代谢抵抗恶病质。在动物模型中,过表达SIRT6的小鼠肿瘤诱导的脂肪流失减少50%以上,肌肉萎缩程度显著减轻,并伴随运动能力改善。细胞模型中,SIRT6过表达抑制而SIRT6敲除加剧肿瘤条件性培养基所诱发的脂解。
机制上,转录组分析表明,SIRT6通过抑制TNFR2介导的脂解信号,阻断脂肪细胞内cAMP-PKA信号通路的过度激活,进而降低脂解酶ATGL、HSL等蛋白的活性,阻断脂肪异常分解。进一步的实验表明,恶病质患者血清TNFR2水平显著升高,且TNFR2中和抗体或SIRT6特异性激活剂MDL800可逆转肿瘤诱导的脂解效应,证明了TNFR2的关键作用。
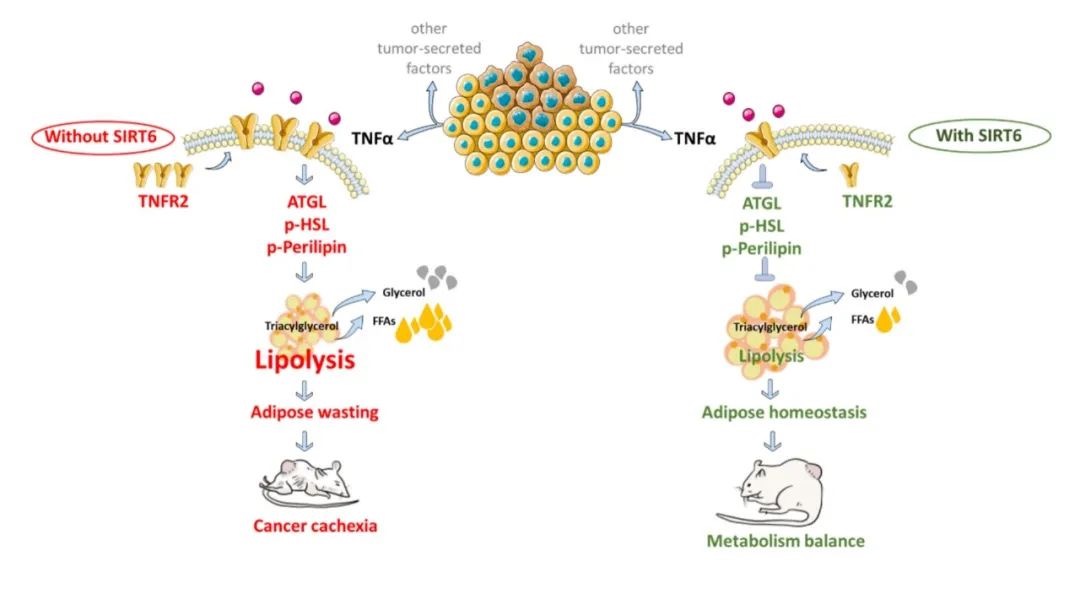
SIRT6蛋白通过抑制TNFR2信号通路缓解癌症恶病质脂肪消耗的关键机制
该研究证实了SIRT6对癌症恶病质的保护作用,首次揭示了SIRT6-TNFR2轴在恶病质脂肪分解中的核心作用,填补了恶病质中脂肪代谢调控机制的空白,为恶病质的治疗提供了重要理论依据。此外,SIRT6过表达对恶病质肌肉萎缩的改善作用也表现出其延缓老年性肌肉萎缩(肌少症)和脂肪再分布等衰老相关的代谢失衡的潜力。
相关研究成果以“SIRT6通过抑制小鼠TNFR2信号通路改善癌症恶病质相关的脂肪消耗”(SIRT6 Ameliorates Cancer Cachexia–Associated Adipose Wasting by Suppressing TNFR2 Signalling in Mice)为题,于2月20日发表于《恶病质、肌少症和肌肉杂志》(Journal of Cachexia, Sarcopenia and Muscle)。
清华大学药学院王钊教授、北京协和医院于康教授、康奈尔大学医学院李忠持博士为论文共同通讯作者。王钊课题组博士毕业生徐康、在读博士生王译达、北京协和医院王方医师为论文共同第一作者。王钊课题组成员郭彦南、任雨,康奈尔大学医学院薇薇安·罗(Vivien Low)、宋云秋(Sungyun Cho)。清华大学药学院刘清飞副教授,清华大学医学院裘莹教授、李雪高级工程师参与了研究工作。
研究得到国家自然科学基金、国家重点研发计划、清华精准医学基金、清华春风基金的资助。
论文链接:
https://onlinelibrary.wiley.com/doi/10.1002/jcsm.13734
本文链接:https://19150.com/cul/21610.html
