清华长庚医院团队发文解读CAR-T细胞疗法全球监管挑战
清华新闻网2月20日电 近日,北京清华长庚医院临床药械试验中心团队发表医药监管科学领域的重要评论性文章,该文章聚焦于嵌合抗原受体T细胞(CAR-T)疗法临床研发与监管,并以西达基奥仑赛(ciltacabtagene autoleuce, cilta-cel)的研发和审批过程为例,深入探讨了细胞疗法的研发与监管挑战以及全球不同监管机构的审评审批差异,为推动创新细胞疗法研发提供策略见解。
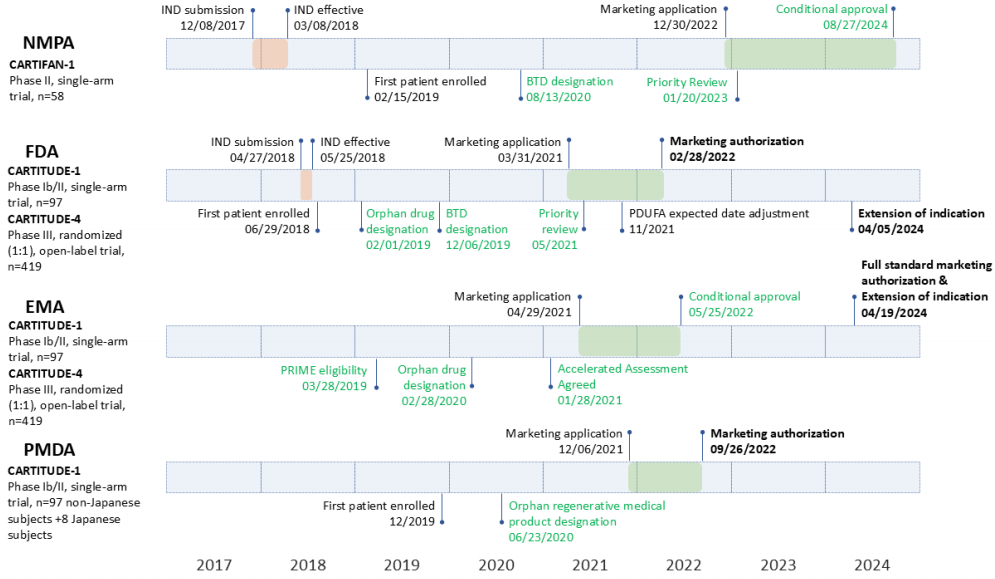
CAR-T细胞疗法是血液恶性肿瘤治疗领域的革命性进展,目前全球已有13款靶向CD19或BCMA的CAR-T产品获批用于多种血液肿瘤。由中美企业合作开发的西达基奥仑赛作为中国首个获得全球多监管机构认可的CAR-T产品备受产业界和学术界关注。该产品于2018年3月在中国首次获得新药临床试验(IND)许可。2022年2月,该产品被美国食品药品监督管理局首次批准上市,随后于同年5月和9月分别获欧洲药品管理局和日本药品和医疗器械管理局批准,最终于2025年8月在中国获得附条件批准。
论文配图
本研究以CAR-T细胞疗法的全球监管框架为背景,重点分析了西达基奥仑赛的研发和审批过程。研究团队通过监管数据库调研、文献综述、案例分析和专家访谈等多种方法,详细梳理了该产品在中国、美国、欧洲和日本等区域的临床试验设计、监管审评流程及决策依据,并结合全球监管机构的公开数据和政策文件,进行了深入的比较分析。
该文章还进一步梳理了CAR-T细胞疗法全球临床研发和监管的复杂性,关键问题包括不同地区监管框架的差异、CMC(化学、制造和控制)变更管理的复杂性、跨国临床试验的细胞制剂转运制约以及将CAR-T细胞疗法推进至前线治疗的考量。此外,产品研发及商业化的高成本和有限的市场规模仍然是该类产品研发过程中亟待解决的挑战,昂贵的价格也是临床应用可及性的难题。随着CAR-T细胞疗法的不断发展,国际合作和监管协同将是推动细胞疗法研发和提高患者可及性的关键。
相关文章以“西达基奥仑赛的跨国批准:透视CAR-T细胞疗法的监管”(International approvals of cilta-cel: a lens on CAR T cell regulation)为题,于2月6日发表于《自然综述·临床肿瘤学》(Nature Reviews Clinical Oncology)。
北京清华长庚医院临床药械试验中心主任、清华大学医学院研究员陈晓媛为论文通讯作者,北京清华长庚医院临床药械试验中心助理研究员葛诚浩为论文第一作者,清华大学医学院(Tsinghua Medicine)临床试验中心助理研究员尹晨为论文第二作者。国家药品监督管理局药品评审中心(CDE)在讨论CAR-T细胞疗法监管方面为本文提供了宝贵意见。本文亦获得传奇生物(Legend Biotech)、强生(Johnson & Johnson)团队、医药魔方Pharmcube数据库的支持。
论文链接:
https://www.nature.com/articles/s41571-025-00996-1
本文链接:https://19150.com/cul/21597.html
