清华李超课题组实现高氧化态DMOA杂萜的全合成
清华新闻网2月12日电 近日,清华大学生物医学交叉研究院李超课题组在《美国化学会志》(Journalof the American ChemicalSociety JACS)上发表题为“DMOA衍生的萜类化合物的全合成:在(+)-Berkeleyacetal D 和(+)-Peniciacetal I的合成中实现选择性”(Total Synthesis of DMOA-Derived Meroterpenoids: Achieving Selectivity in the Synthesis of (+)-Berkeleyacetal D and (+)-Peniciacetal I)的论文,首次实现高氧化态DMOA杂萜berkeleyacetal D和peniciacetal I的不对称全合成。该工作通过一系列创新性策略攻克了复杂分子骨架构建与多重选择性控制难题。
DMOA来源的杂萜是一类生源上由萜类前体法尼基焦磷酸和3,5-二甲基苔色酸(DMOA)经多步酶催化反应后形成的天然产物。目前,已有超过200个该类天然产物被分离报道。此类天然产物结构复杂多样,同时兼具抗炎、抗肿瘤等显著生物活性,吸引了很多化学合成课题组的关注。例如,加州大学伯克利分校(UC Berkeley )的马蒙(Maimone)课题组、耶鲁大学(Yale)的纽豪斯(Newhouse)课题组、北京大学的黎后华课题组和兰州大学的谢志翔课题组,在近几年先后完成了DMOA-杂萜家族中berkeleyone A及其同系物的全合成。2022年波士顿大学(Boston University)的波科(Porco)课题组完成了一类螺环DMOA杂萜的全合成。在李超课题组发表该合成工作的同时,北京大学的杨震课题组在JACS发表了一篇关于DMOA-杂萜janthinoid A的全合成工作。但目前关于DMOA-杂萜中berkeleyacetals亚型天然产物(大于50个天然产物)的全合成还没有报道,这主要是缘于其极其复杂的化学结构和高度的氧化态。以本合成工作中的berkeleyacetal D为例:在分子结构上,其分子骨架包含6/7/6/5/6五环稠合体系,骨架上18个碳原子中17个被官能团化或构成立体中心(含8个手性中心)。从生源合成角度上看,从已被合成攻克的berkeleyone A到本研究的berkeleyacetal D需要经过10多步转化,虽然目前这些生源转化还没有被完全揭示清楚。从氧化态上看,该分子氧化程度之高令人惊叹,其分子式C24H26O7,碳氢比例接近1:1。
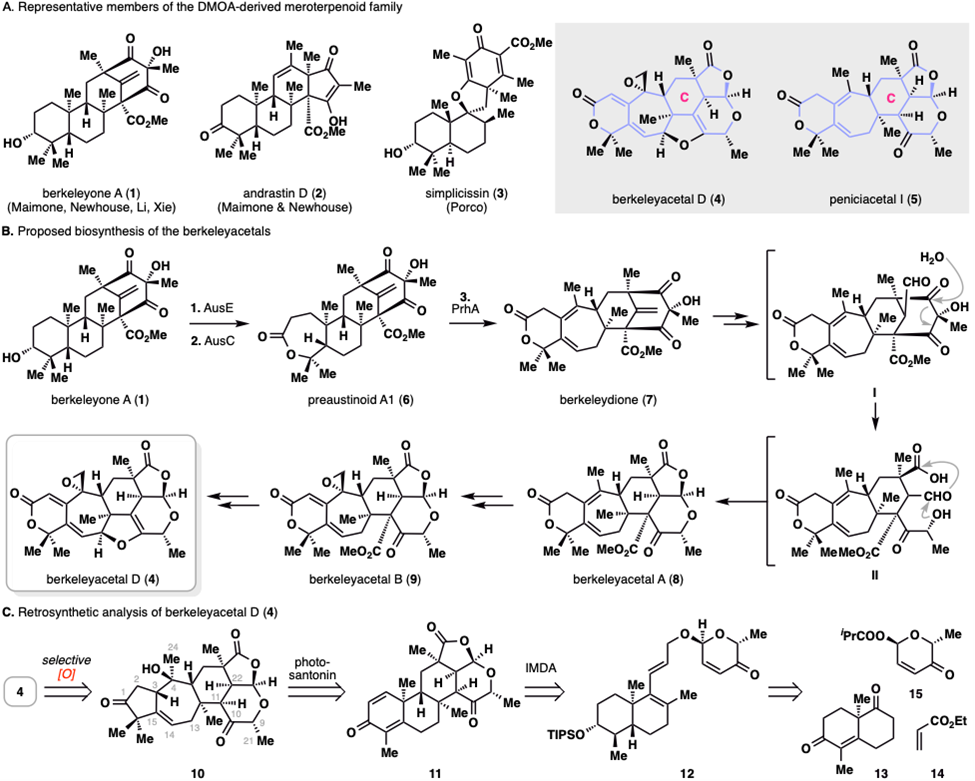
此前合成的代表性DMOA杂萜和berkeleyacetal D和peniciacetal I的分子结构,berkeleyacetal D的生源合成及逆合成分析
在本研究中,李超课题组针对berkeleyacetal D和peniciacetal I的复杂结构提出了一种选择性导向的合成策略,通过一系列化学选择性(chemoselective)、区域选择性(regioselective)和立体选择性(stereoselective)的化学转化,成功完成了(+)-berkeleyacetal D和(+)-peniciacetal I的化学全合成。此外,在此合成中,研究人员还发现了两个非常新颖的化学转化:六氟苯参与的立体选择性环氧化反应和共轭烯醇负离子对三级溴化物的单电子还原构建二氢呋喃的反应。下面列举该合成中的几个关键合成步骤:
研究人员通过路易斯酸AlCl3的精准调控,在低温下实现了三烯化合物12的分子内endo-selectiveDiels–Alder反应,成功构建了目标天然产物中拥挤的C环结构。而如果直接通过加热进行Diels–Alder反应,则会立体选择性地获得exo环化产物。
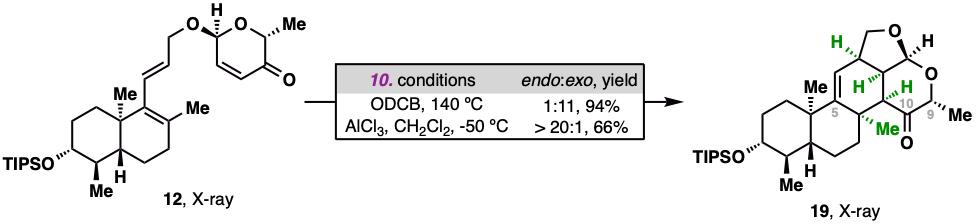
Endo-selective Diels–Alder反应构建分子骨架
鉴于目标天然产物分子的复杂性和高氧化性,除了上述endo-selective Diles–Alder反应,在此合成路线中,还涉及到非常多的选择性问题,而这些选择性的问题都被研究人员通过反应条件的优化进行解决,包括化学选择性和立体选择性的甲基化反应、Baeyer-Villiger氧化反应、三级醇的脱水反应、酮的a,b-脱氢反应、氢化反应等。
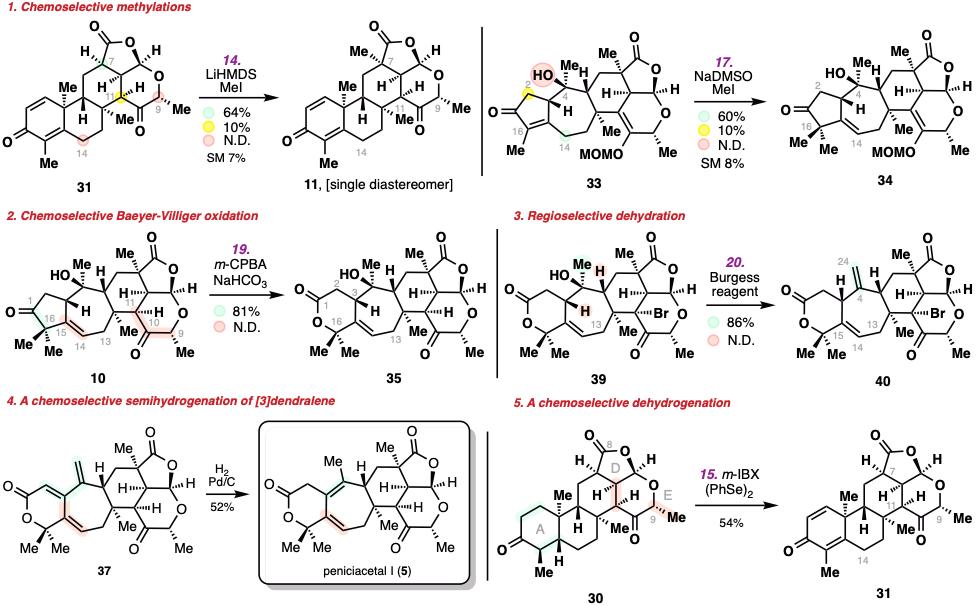
复杂分子上实现多重化学选择性的突破
在构建berkeleyacetal D关键的C4–C24环氧化步骤中,常规条件产生不利的β-面环氧化物。团队发现六氟苯(HFB)作为共溶剂可能通过π-给受体作用改变反应过渡态,将α-面环氧化产物的比例从1:2.4逆转为2.3:1,收率高达93%。
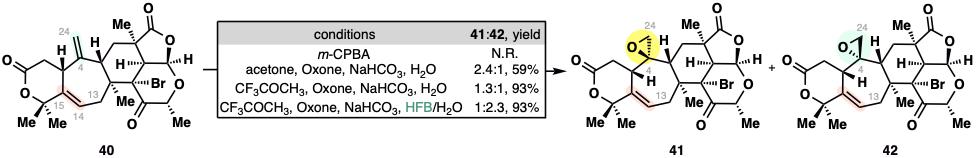
溶剂参与的立体选择性环氧化的新发现
最后一步,研究人员通过化学选择性去质子化即直接获得了目标天然产物berkeleyacetal D,详细的机理研究表明这步化学转化的机理涉及共轭烯醇负离子通过分子内单电子转移(SET)还原分子内的三级溴化物,进而巧妙地实现2,3-二氢呋喃环的构建。此外,机理研究表明,光照可促进该过程,但研究人员最终选择不额外加光的条件以避免副反应。
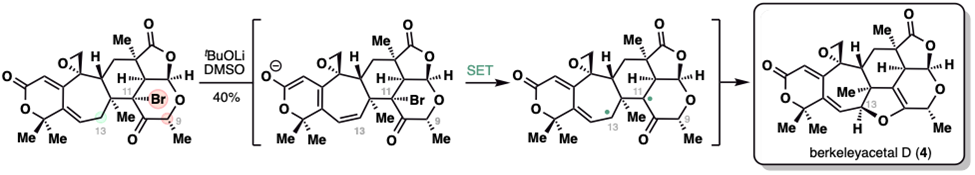
新型分子内单电子转移构建二氢呋喃环
该工作不仅填补了DMOA-杂萜全合成领域的空白,更展示了多重选择性控制策略在复杂分子合成中的价值。此外,这些在复杂分子上实现的这些选择性,将会很好地促进DMOA-杂萜及其他复杂天然产物的合成工作。更重要的是,研究人员发现的六氟苯参与的立体选择性环氧化和共轭烯醇负离子对三级溴化物的单电子还原反应对相应合成方法学的开发也具有启发意义,凸显了天然产物全合成促进合成化学发展的重要性。
李超实验室2019级PTN项目的张建鹏博士为论文的第一作者。李超研究员为论文的通讯作者。李超实验室2021级博士生骆筱桐和2024级博士生张靖富对本工作有重要贡献。北京大学罗佗平教授、斯克里普斯(Scripps)研究所菲尔·巴兰(Phil S. Baran)教授以及北京大学医学部黎后华教授为研究提出宝贵意见。协和药物所胡友财教授、北京中医药大学史社坡教授、海南师范大学陈光英教授、中山大学佘志刚教授提供天然产物原始谱图。研究得到北京生命科学研究所和清华大学的支持。
论文链接
https://pubs.acs.org/doi/10.1021/jacs.4c15205
本文链接:https://19150.com/cul/21580.html
